Эндоваскулярное закрытие дефекта межпредсердной перегородки
Содержание:
- Как определить болезнь
- Эндоваскулярный (внутрисосудистый) метод закрытия ДМПП
- Причины дефекта межпредсердной перегородки
- Лечение
- Патофизиологические изменения
- Симптомы ostium primum
- Причины АМПП
- Формы АМПП
- Почему может возникать патология
- Диагностика
- Часто задаваемые вопросы
- Развитие аневризмы
- Разновидности и последствия патологии
- Часто задаваемые вопросы
- Что такое вторичный дефект межпредсердной перегородки?
Как определить болезнь
Диагноз «приходит» к каждому по-разному. Вы можете, еще нося под сердцем малыша, узнать об имеющейся у него патологии, либо неонатолог сразу после рождения сообщит вам про вторичный дефект межпредсердной перегородки у новорожденного, а иногда бывает, что подростка вдруг начинают беспокоить неприятные ощущения в области грудной клетки, и обследование выявляет ДМПП.
Симптомы и признаки
Я ни в коем случае не призываю «искать болезни» у ребенка. Лишь хочу напомнить, что своевременная диагностика и коррекция нарушений позволят малышу сохранить здоровье, обеспечить полноценную работоспособность, качество жизни, избежать инвалидности. Советую обратиться к педиатру, если Вы вдруг заметите следующие симптомы у ребенка:
- чрезмерную усталость;
- одышку после физической нагрузки;
- жалобы на учащение сердцебиения;
- бледность или цианоз (синеватый оттенок кожи).
Дошкольник не всегда способен точно описать свое состояние. Вы можете обнаружить, что малыш чаще присаживается отдохнуть, чем другие дети, чаще простужается. А банальная вирусная инфекция у него вдруг осложняется пневмонией. «Перебои в сердце» при латентном течении ДМПП обычно проявляются в подростковом возрасте.
К счастью, обычно ДМПП характеризуется бессимптомным течением, ребенка ничего не тревожит, но если врачи диагностировали дефект межпредсердной перегородки, важно проходить профилактические медицинские обследования, чтобы не пропустить первые клинические признаки легочной гипертензии
УЗИ-критерии
При аускультации, скорее всего, Ваш педиатр выявит систолический, реже – диастолический шум, расщепление второго тона. Но достаточно часто, даже при дефектах больших размеров, в случае ДМПП уловить ухом изменение мелодии сердца не всегда возможно.
Диагностические возможности УЗИ в случае ДМПП включают:
- Непосредственное определение дефекта, его размеров, формы, локализации. Благодаря двухмерному изображению осматривается вся межпредсердная перегородка. Отдельные авторы рекомендуют оценивать отверстие в трех проекциях.
- Увеличение размеров правого предсердия и желудочка.
- При цветном доплеровском картировании определение сброса через дефект крови слева направо, скорость кровотока.
- Выявление парадоксального характера движения межжелудочковой перегородки – наблюдается в случае отсутствия легочной гипертензии при сбросе крови слева направо. Если объем шунтированной крови невелик, а легочное систолическое давление высокое, данный симптом обычно не выявляется (часто в период новорожденности).
- Исключение других врожденных аномалий (комбинированного порока).
Детальная визуализация дефекта и изменений гемодинамики необходимы для определения дальнейшей тактики ведения пациента. Иногда Ваш кардиолог может направить ребенка повторно на эхокардиографию через какое-то время после первого обследования. Это нужно, чтобы уточнить, насколько имеющееся отверстие в межпредсердной перегородке влияет на функциональное состояние сердца и динамику кровообращения.
Дополнительные методы диагностики
Электрокардиографическое исследование не даст представления об анатомических аномалиях главного насоса организма. На ЭКГ будут отражаться изменения, характеризующие гипертрофию правых отделов сердца и нарушения ритма:
- отклонение электрической оси вправо;
- блокада ножки пучка Гиса;
- аномальная ось зубца Р.
На рентгенографии органов грудной клетки специалист увидит увеличение правого предсердия и желудочка, выбухание дуги легочной артерии, усиление легочного рисунка. Иногда требуется магнитно-резонанстная томография. Дополнительные методы исследования помогают оценить, насколько отверстие в межпредсердной перегородке влияет на деятельность сердца.
Эндоваскулярный (внутрисосудистый) метод закрытия ДМПП
Схема имплантацииокклюдера
Эндоваскулярный (внутрисосудистый) метод закрытия дефекта межпредсердной пререгородки (ДМПП) начал развиваться с 1975 года. Устройство для эндоваскулярного закрытия дефекта получило название окклюдер. В последующие годы было испытано несколько поколений окклюдеров, но только с 2001 года устройства получили международное одобрение для использования в повседневной медицинской практике.
Современные окклюдеры обладают необходимыми качествами для использования:
- имеют легкую и удобную систему доставки непосредственно к дефекту,
- полностью выполняют отверстие дефекта,
- обладают способностью к репозиционированию и извлечению в сложных анатомических случаях.
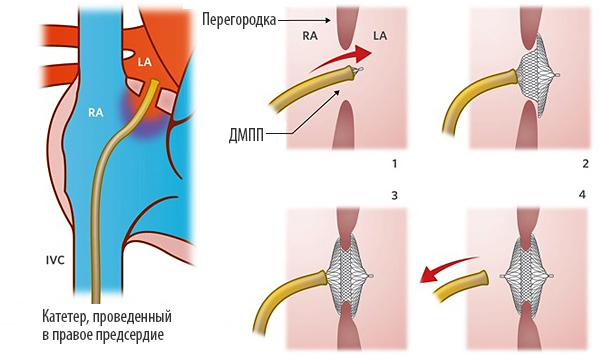 Этапы эндоваскулярной имплантации окклюдера ДМПП
Этапы эндоваскулярной имплантации окклюдера ДМПП
В мировой медицинской практике эндоваскулярное закрытие ДМПП стало операцией выбора, то есть первоочерёдным и оптимальным методом лечения. Закрытие вторичного ДМПП с помощью эндоваскулярной технологии с использованием окклюдера возможно в 80% случаев. Возможность эндоваскулярного метода лечения определяется анатомо-морфологическими характеристиками дефекта.
Преимущества методики:
- отсутствие разрезов и швов на теле;
- проведение операции через прокол бедренной вены;
- без наркоза, под местным обезболиванием;
- отсутствие длительной реабилитации после проведения операции;
- возможность вернуться к повседневной жизни через несколько дней после операции.
Для определения возможности выполнения операции эндоваскулярного закрытия ДМПП проводится трансторакальное Эхо-Кг и чреспищеводное Эхо-Кг.
После оценки показателей данных исследований принимается решение об анатомической и морфологичсекой возможности выполнения операции.
Причины дефекта межпредсердной перегородки
В основе формирования дефекта межпредсердной перегородки лежит нарушение развития первичной или вторичной перегородки в эмбриональном периоде.
- Первичный дефект располагается в нижней части межпредсердной перегородки рядом с фиброзными кольцами атриовентрикулярных клапанов (митрального и трехстворчатого), по сути его нижним краем является само фиброзное кольцо.
- Вторичный дефект располагается в центральной части межпредсердной перегородки, и все его края представлены самой перегородкой.
- Дефект венозного синуса – это дефект, локализующийся в верхней части межпредсердной перегородки. Данному пороку часто сопутствует аномальный дренаж лёгочных вен (часть лёгочных вен впадает не в левое предсердие, а в верхнюю полую вену).
Лечение
Если ребенок быстро утомляется во время еды, плохо прибавляет в весе, испытывает одышку во время плача, которая сопровождается цианозом губ и ногтей, следует немедленно обратиться к врачу.
Консервативная терапия
Медикаментозная терапия патологии является симптоматической и заключается в назначении больным сердечных гликозидов, диуретиков, ингибиторов АПФ, антиоксидантов, бета-блокаторов, антикоагулянтов. С помощью медикаментов можно улучшить сердечную функцию, обеспечить нормальное кровоснабжение.

- Сердечные гликозиды оказывают избирательное кардиотоническое действие, урежают сердцебиение, повышают силу сокращения, нормализуют артериальное давление. К препаратам данной группы относятся: «Коргликон», «Дигоксин», «Строфантин».
- Диуретики удаляют избыток жидкости из организма и понижают кровяное давление, снижают венозный возврат к сердцу, уменьшают выраженность внутритканевых отеков и застойных явлений. При острой форме сердечной недостаточности назначают внутривенное введение «Лазикса», «Фуросемида», а при хронической – таблетки «Индапамид», «Спиронолактон».
- Ингибиторы АПФ оказывают гемодинамический эффект, связанный с периферической артериальной и венозной вазодилатацией, не сопровождающейся увеличением ЧСС. У больных с застойной сердечной недостаточностью ингибиторы АПФ уменьшают дилатацию сердца и повышают сердечный выброс. Больным назначают «Каптоприл», «Эналаприл», «Лизиноприл».
- Антиоксиданты оказывают гипохолестеринемическое, гиполипидемическое и антисклеротическое действие, укрепляют стенки сосудов, выводят свободные радикалы из организма. Их применяют для профилактики инфаркта и тромбоэмболии. Наиболее полезными антиоксидантами для сердца являются витамины А, С, Е и микроэлементы: селен и цинк.
- Антикоагулянты снижают свертываемость крови и препятствуют образованию тромбов. К ним относятся «Варфарин», «Фенилин», «Гепарин».
- Кардиопротекторы защищают миокард от повреждений, оказывают положительное влияние на гемодинамику, оптимизируют работу сердца в норме и при патологии, предупреждают воздействие повреждающих экзогенных и эндогенных факторов. Самыми распространенными кардиопротекторами являются «Милдронат», «Триметазидин», «Рибоксин», «Панангин».
Эндоваскулярная хирургия
Эндоваскулярное лечение в настоящее время является очень популярным и считается самым безопасным, быстрым и безболезненным. Это малоинвазивный и малотравматичный метод, предназначенный для лечения детей, склонных к парадоксальной эмболии. Эндоваскулярное закрытие дефекта проводят с помощью специальных окклюдеров. Пунктируют крупные периферические сосуды, через которые к дефекту доставляют специальный «зонтик» и открывают его. Со временем он зарастает тканью и полностью закрывает патологическое отверстие. Такое вмешательство проводят под контролем рентгеноскопии.

эндоваскулярное вмешательство – наиболее современный метод коррекция порока
Ребенок после эндоваскулярной операции остается абсолютно здоровым. Катетеризация сердца позволяет избежать развития тяжелых послеоперационных осложнений и быстро восстановиться после операции. Подобные вмешательства гарантируют абсолютно безопасный результат лечения ВПС. Это интервенционный метод закрытия ДМПП. Размещенное на уровне отверстия устройство закрывает аномальное сообщение между двумя предсердиями.
Хирургическое лечение
Открытую операцию проводят под общей анестезией и в условиях гипотермии. Это необходимо для того, чтобы снизить потребность организма в кислороде. Хирурги подключают больного аппарату «искусственное сердце-легкие», вскрывают грудную и плевральную полость, рассекают перикард кпереди и параллельно диафрагмальному нерву. Затем разрезают сердце, аспиратором удаляют кровь и непосредственно устраняют дефект. Отверстие размером менее 3 см просто ушивают. Большой дефект закрывают путем имплантации лоскута из синтетического материала или участка перикарда. После наложения швов и повязки ребенка переводят в реанимацию на сутки, а затем в общую палату на 10 дней.
Патофизиологические изменения
Если отверстие в стенке между предсердиями значительных размеров, то в них происходит смешивание артериального и венозного потоков. Так как давление в левой половине сердца сильнее, часть крови «сбрасывается» через дефект в правое предсердие (шунт «слева направо»), «вынуждая» последнее работать с чрезмерной нагрузкой. Следовательно, правый желудочек тоже получает больший объем крови и «перегружается».
Если своевременно не устранить обширный дефект, могут возникнуть повышение давления в малом круге кровообращения (легочная гипертензия), нарушения сердечного ритма по типу суправентрикулярных аритмий, фибрилляции, трепетания предсердий. С усугублением процесса правый желудочек перестает справляться с нагрузкой, давление в нем начинает расти, в результате чего возникает синдром Эйзенменгера («обратный сброс» крови, справа налево).
Симптомы ostium primum
Чаще всего проявляются в детстве. Патология составляет около 15% всех ДМПП, характеризуется достаточно большим изъяном в перегородке. Отличительной особенностью является сочетание порока с другими аномалиями:
- недостаточностью митрального клапана сердца;
- синдромом Дауна;
- расщеплением передней части митрального клапана.
Дети с данным заболеванием жалуются на трудности при дыхании, одышку, которая усиливается во время физической нагрузки, приступы сильного сердцебиения.
Значительные дефекты приводят к развитию ранней сердечной недостаточности, которая характеризуется следующими симптомами:
- отеки рук, ног, передней брюшной стенки;
- кашель с мокротой;
- боли в груди;
- синюшность конечностей, носогубного треугольника и пр.
Пациенты с незначительной степенью патологии живут до 45-50 лет. При этом у всех отмечается выраженная клиническая картина.
Причины АМПП
Риск возникновения АМПП берет свое начало во время эмбриогенеза человека. Дело в том, что подавляющее большинство АМПП развивается на месте овального открытого окна (ОО). ОО – отверстие соединяющее левое и правое предсердие, когда ребенок находится в утробе матери.
У ребенка в утробе нет возможности дышать легкими. Поэтому часть крови следует из правого предсердия к легким, чтобы обеспечить их питание и развитие. А остальная часть крови сбрасывается через ОО в левое предсердие и направляется на большой круг кровообращения, для питания всего организма.
После рождения, когда ребенок делает свой первый вдох, и начинает функционировать малый круг кровообращения, необходимость в ОО отпадает. При нормальных условиях оно зарастает в течении нескольких дней. Заросший участок является слабой точкой в перегородке и подвержен максимальным деформациям.
Важно! Закрытие отверстия в течении нескольких месяцев не считается патологией. Здоровая МПП способна выдерживать давление крови без изменения формы
Однако существует ряд факторов, нарушающих нормальное анатомическое строение перегородки и провоцирующих выпячивание.
Здоровая МПП способна выдерживать давление крови без изменения формы. Однако существует ряд факторов, нарушающих нормальное анатомическое строение перегородки и провоцирующих выпячивание.
Для детей характерна только врожденная АМПП. Главной ее причиной, в большинстве случаев, является образ жизни матери во время беременности и состояние ее здоровья. К факторам, которые вызывают АМПП у младенцев относят:
- Наследственную предрасположенность;
- Инфекционные заболевания во время беременности;
- Курение и употребление алкоголя во время беременности;
- Применение лекарств оказывающих неблагоприятное, тератогенное действие;
- Неблагоприятные условия окружающей среды;
- Авитаминоз.
У взрослых АМПП возникает из-за сердечных патологий, которые ослабляют ткани перегородки.
- Инфаркт миокарда;
- Миокардит;
- Кардиомиопатия.
Приобретенная АМПП классифицируется по скорости развития заболевания:
- Острая аневризма – возникает в течении двух недель после перенесенного инфаркта. Сопровождается повышенной температурой, аритмией и и аномально большим количеством лейкоцитов в крови.
- Подострая аневризма – развивается от трех до шести недель. Аневризма возникает из-за нарушенного формирования соединительной ткани на месте погибших кардиомиоцитов. Сопровождается сердечной недостаточностью и отеком в ногах.
- Хроническая аневризма – развивается более шести недель. Симптоматика соответствует застойной сердечной недостаточности.
Эта классификация необходима для составления плана лечения и прогнозирования заболевания.
Формы АМПП
У АМПП широкая классификация, которая строится как на анатомических особенностях заболевания, так и на причинах и особенностях его возникновения.
Первоначальная анатомическая классификации выделяла три типа АМПП:
- P – Аневризма выпячивается в правое предсердие;
- L – Аневризма выпячивается в левое предсердие;
- S — образная. В этом случае разные участки перегородки выпячиваются в разные предсердия, образуя S — образный изгиб.
Современная классификация выделяет 5 форм, которые позволяют более точно анализировать особенности гемодинамики:
- Тип 1R. АМПП выгибается в правое предсердие от центра перегородки в процессе сердечных сокращений.
- Тип 2L. АМПП выгибается в левое предсердие от центра перегородки.
- Тип 3RL. Максимальное выпячивание аневризмы в правое предсердие с последующим частичным выгибанием в левое, в процессе сердечных сокращений.
- Тип 4LR. Максимальное выпячивание аневризмы в левое предсердие с последующим частичным выгибанием в правое.
- Тип 5. Аневризма равномерно выгибается в правое и левое предсердие.
Классификация АМПП по характеру возникновения:
- Врожденные. Обнаруживаются уже в детском возрасте и основными их причинами становятся нарушения эмбрионального развития.
- Приобретенные. Характерны для взрослых людей и возникают в течении жизни.
Классификация АМПП по степени вовлеченности межпредсердной перегородки:
- Частичный. Наиболее распространенный тип, при котором аневризма формируется из ограниченного участка перегородки.
- Генерализованный. Вся МПП подвержена аневризматическому растяжению.
Помимо первичной аневризмы, возникшей из-за анатомических нарушений в тканях, выделяют вторичную АМПП. Она может возникнуть даже на здоровой перегородке в результате слишком сильного кровяного давления в сердце, вызванного другими патологиями. В этом случае лечение направлено на борьбу с заболеванием, ставшим причиной аневризмы.
Почему может возникать патология
Ученые до сих пор не пришли к единому мнению касательно того, почему развивается аневризма сердца у ребенка. Хотя подобная аномалия развития – не новость в медицине. О такой патологии ученые знают давно, но из-за недостаточных возможностей диагностики ее выявляли значительно позже, когда запускался процесс разного рода осложнений. Сегодня все изменилось. Предварительный диагноз врачи могут поставить еще на стадии внутриутробного развития, а потом подтвердить или опровергнуть его с помощью УЗИ, когда ребенок появится на свет.
Аневризму сердца у ребенка относят к достаточно редко встречающемуся нарушению строения. По данным ученых из Ярославской государственной медицинской академии, она наблюдается у 2,5% доношенных новорожденных детей. От тяжелых пороков сердца ее отличает минимальность дефекта, отсутствие нарушений сократимости органа, смыкания клапанов сердца и тока крови по сосудам.
Ученые уже более 35 лет плотно изучают МАРС-синдром и пока не могут точно предсказать, какими проблемами может обернуться такое нарушение в каждом конкретном случае, угрожает ли он дальнейшей жизни малыша или никак себя проявлять не станет.
Диагностика
Осмотр пациента с аускультацией (выслушиванием) сердца выявляет шумы в сердце.
ЭКГ выявляет гипертрофию миокарда правого желудочка, блокаду правой ножки пучка Гиса, аритмии разной степени тяжести, резкое отклонение электрической оси сердца влево.
Рентгенография органов грудной клетки выявляет расширение ствола легочной артерии, увеличение сердца, усиление лёгочного рисунка.
Трансторакальная эхокардиография позволяет не только визуализировать дефект межпредсердной перегородки и уточнить его характер (первичный, вторичный, дефект венозного синуса), но также оценить направление сброса крови через дефект и его гемодинамическую значимость (Qp/Qs)
Чреспищеводная эхокардиография у взрослых позволяет получить детальную информацию о краях дефекта, что важно для выбора метода оперативного лечения. Зондирование камер сердца и атриография используется при недостаточной информации от вышеописанных методов исследования или как часть уже оперативного лечения
Часто задаваемые вопросы
Среднее время пребывания в стационаре 3-4 дня. Как правило, в день поступления утром вы проходите обследование, включающее в себя клинический и биохимический анализ крови (приезжать нужно натощак), делаете рентгеновский снимок, ЭКГ, ультразвуковое исследование сердца и консультацию кардиолога и кардиохирурга. Если все показатели в норме, на следующий день проводится операция по устранению порока. На третий день мы проводим контрольные исследования и выписываем Вас.
Для госпитализации в наш стационар вам понадобится паспорт или свидетельство о рождении ребенка.
Если пациент детского возраста, нужна справка о санэпидокружении (о том, что в последнее время ребенок не контактировал с инфицированными больными), которую вы получите в поликлинике по месту жительства.
Желательно иметь при себе предыдущие консультативные заключения, ЭКГ и рентгеновский снимок органов грудной.
Направление от кардиолога по месту жительства НЕ ТРЕБУЕТСЯ. Вы можете приехать на консультацию и последующее лечение в порядке самообращения. Если Вам более 30 лет или вы ощущали перебои в работе сердца, желательно провести холтеровское мониторирование по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня.
Если вы страдаете хроническим гастритом, язвенной болезнью желудка или двенадцатиперстной кишки необходимо сделать фиброгастродуоденоскопию. В случае подтверждения заболевания, Вам необходимо пройти курс лечения по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня в случае отсутствия язв и эррозий.
Как правило, длительность операции в пределах 1-1,5часа. Но при сложных анатомических вариантах время операции может увеличится.
Всем взрослым пациентам операция проводится под местной анестезией. Пациент может наблюдать за ходом операции и общаться с персоналом. Исключение составляют пациенты с дефектом межпредсердной перегородки, которым во время операции требуется контроль транспищеводного УЗИ и для комфорта пациента операция проводится в состоянии медикаментозного сна. Все эндоваскулярные операции у детей и мнительных пациентов проводятся под общей анестезией.
Самый неприятный момент — это укол местного анестетика в паховую область. Затем болевая чувствительность полностью исчезает.
Через 3-6 месяцев имплантированные устройства полностью прорастают своими клетками — покрываются эндотелием и их уже не отличить от внутренней поверхности сердца. Все устройства выполнены из высокотехнологичного медицинского сплава, который не вызывает реакций отторжения или аллергических реакций.
Нет, установленные устройства не ощущаются.
Да, на КТ ограничений нет. На МРТ производители имплантов гарантируют безопасность при 1,5 и 3 Тесла. Перед обследованием обязательно сообщите радиологу о том, что у Вас установлен внутрисердечный имплант.
Необходимо ограничить сильную физическую нагрузку на 6 месяцев. Необходима профилактика респираторных инфекций, тонзиллита, кариеса. В случае, если заболевание начало развиватьс я, в схему лечения нужно включить антибактериальные препараты, после консультации с врачом. В течении первого месяца после операции необходимо также ограничить половую жизнь.
Немедленно вызовите скорую помощь, указав по телефону какой вид операции Вы перенесли. Затем перезвоните врачу, который делал операцию.
Развитие аневризмы
Многие родители хотят более подробно узнать о том, что это – аневризма межпредсердной перегородки у новорожденного, и как она влияет на работу главного «мотора» организма. Чтобы разобраться в этом, необходимо заглянуть в строение сердца. У большинства внутренних органов человеческого тела имеется каркас из соединительной ткани. Ее закладывание происходит во время внутриутробного развития. Именно благодаря соединительной ткани орган приобретает характерную для него форму, не искривляется, не растягивается, сохраняя свою функциональность. Из соединительнотканных волокон состоит не только каркас, но и клапаны сердца, наделенные эластичностью и высоким запасом прочности.
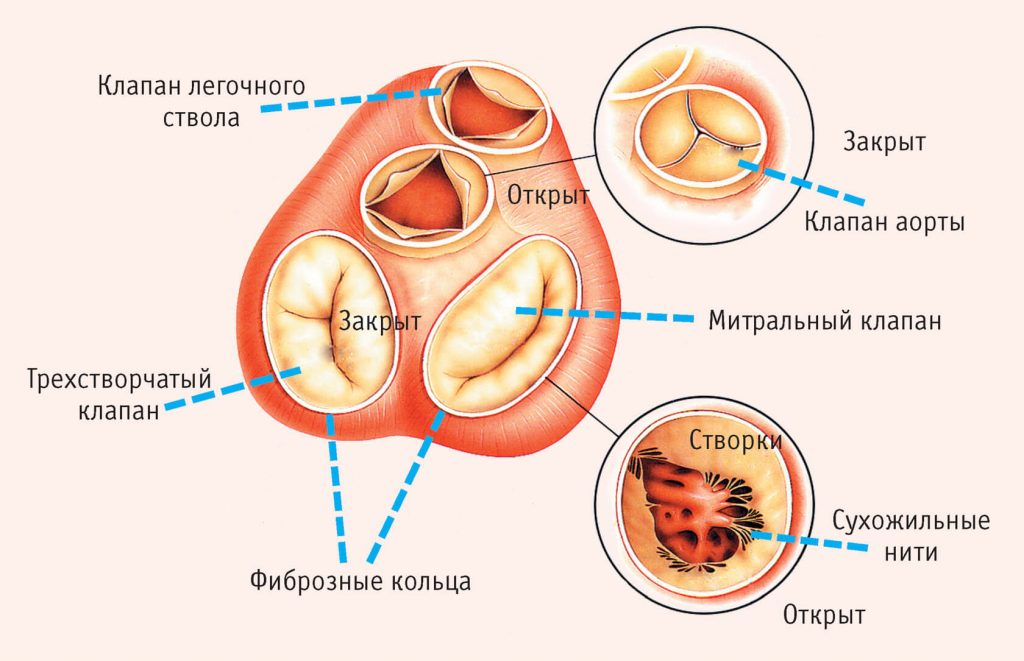
Соединительная ткань участвует в образовании отходящих от сердца крупных «магистралей» – аорты, легочных вен, легочного ствола. Предпосылками для возникновения МАРС-синдрома является дисплазия соединительной ткани, изменение ее строения. В результате в одном месте волокна формируются слишком тонкими, легко растяжимыми, а в другом – жесткими, грубыми. Это приводит к появлению незначительных анатомических дефектов, к которым относят аневризму у детей. Причину ученые видят в снижении концентрации определенных видов фибриллярных белков или нарушение их пропорций, которое изменяет структуру соединительной ткани.
Большую роль в этом играет наследственность, а также внешние неблагоприятные факторы. Вредные привычки будущей мамы, перенесенные ею инфекции тоже могут внести негативную лепту в этот процесс.
Разновидности и последствия патологии
Аневризма межпредсердной перегородки представляет собой аномальное выбухание стенки между предсердиями в одну из сторон. Чаще всего выпячивание происходит в сторону, где находилось открытое овальное окно (ООО), так как в этом месте сердечная мышца ещё недостаточно прочна. Овальное окно между предсердиями необходимо плоду в период нахождения в утробе матери, когда у него ещё не функционирует лёгочное дыхание. Оно способствует перераспределению кровотока между левым и правым предсердиями и после появления младенца на свет должно закрываться.
Однако в практической деятельности специалистов медицинских центров «Целитель» в Махачкале встречаются такие случаи, когда окно у новорожденного остаётся открытым или не полностью закрытым в течение достаточно длительного времени (год и более). Это приводит к тому, что под давлением кровотока недостаточно окрепшая стенка миокарда начинает выпячиваться в какую-то сторону. Во врачебной практике сочетание аневризмы с имеющим место дефектом перегородки у детей встречается намного чаще, чем отдельно АМПП без каких-то дополнительных патологий сердца.Типы аневризмы классифицируют в зависимости от того, в какую сторону направлен прогиб межпредсердной перегородки, такие как:
- С выпячиваением в правое предсердие.
- В левое предсердие.
- S-образная, при которой разные части перегородки выбухают в разные стороны.
Если возникновение аневризмы не приводит к перераспределению кровотока из одной сердечной камеры в другую, то опасности такая патология не представляет, прогноз можно назвать благоприятным. В противном случае вследствие возрастания кровяного давления в лёгочном стволе возможно развитие лёгочной гипертензии.
Часто задаваемые вопросы
Каким способом производится обезболивание при операции?
Анестезия может быть как местной, так и общей. Выбор зависит от решения врачей, которые будут проводить эту операцию. Если пациент хорошо переносит общий наркоз, то вполне возможен этот вариант, чтобы исключить волнение и неприятные ощущения.
Как осуществляется контроль за выполнением эндоваскулярного вмешательства?
Достаточно часто требуется уточнение строения дефекта, тогда на этом этапе выполняют ангиографию – рентгеноконтрастное исследование сосудов. Окклюдер подбирают индивидуально, его помещают в катетер и доводят до сердца. Затем, под контролем с помощью видеоизображений, производится установка и раскрытие окклюдера.
Если требуется дополнительный контроль над работой сердца, то используют эхокардиограф с датчиком, помещаемым в пищевод. Чреспищеводная Эхокардиография позволяет наблюдать за состоянием сердечной мышцы в режиме реального времени.
Как проводится реабилитация после манипуляции?
Общий срок проведения операции – не более 1,5-2 часов. Обычно процедура занимает около часа. Госпитализация производится на срок от суток до недели – зависит от индивидуального состояния пациента. После операции назначают прием антикоагулянтов – препаратов, препятствующих образованию тромба, а также антибиотиков, которые позволяют избежать бактериальной инфекции сердца.
Если в послеоперационном периоде не возникает осложнений, то требуется контрольное обследование через 3-4 недели. Иногда возникают такие симптомы, как боли и одышка. При появлении осложнений необходимо обратиться к лечащему врачу – при правильно проведенной операции побочные эффекты не развиваются.
Что такое вторичный дефект межпредсердной перегородки?
Вторичные дефекты встречаются чаще, чем первичные. Конкретное местонахождение отверстия в этом случае бывает различным, но всегда сохраняется край межпредсердной перегородки на границе с предсердно-желудочковыим отверстием.
Читайте больше о кардиологическом отделении больницы Шиба — http://www.hospital-direct.org.il/cardiology-department.aspx.
В зависимости от точной зоны дислокации дефекта, он классифицируется как центральный, нижний, верхний, задний, передний, а также встречаются множественные дефекты. Вторичный дефект межпредсердной перегородки может быть как самостоятельным пороком сердца, так и встречаться в сочетании с другими его пороками, например, при нарушении развития венозного синуса или при наличии аномального дренажа легочных вен справа и верхней полой вены.
Размер дефекта, имеющий определяющее значение на состояние больного, может варьировать у разных пациентов в очень широких пределах — от 1 см до, практически, полного отсутствия межпредсердной перегородки.
Примерно у 15% детей, родившихся со вторичным дефектом межпредсердной перегородки, это отверстие может закрываться на первом году жизни. Но если этого не произошло, то в более поздние сроки самостоятельное закрытие, практически, не наблюдается. Поскольку сердечнососудистая система человека обладает довольно большими компенсаторными возможностями, то патологические изменения в ней при этом пороке развиваются довольно медленно. Симптомы болезни у детей первого года жизни наблюдаются лишь в случае наличия больших дефектов. Количество таких больных составляет не более 1%. Поскольку патологический механизм нарушения кровообращения выражен перемещением части крови из левого предсердия в правое, то наблюдается перегрузка правых отделов сердца. Сначала развивается гипертрофия правого желудочка, в дальнейшем к ней присоединяется повышение давления в легочной артерии. Следующим этапом развития болезни служат изменения, появляющиеся в легких. Как правило, это происходит в возрасте около16 лет.