Лечение острого коронарного синдрома без стойкого подъема сегмента st на экг*,**
Содержание:
- Используемые источники
- Течение заболевания и стратификация риска при ОСН
- Литература
- Формулировка диагноза
- Классификации ОСН при остром коронарном синдроме и инфаркте миокарда
- Определение понятия «острая сердечная недостаточность»
- Фармакотерапия ОКС у пациентов с ХБП
- Критерии оценки элевации сегмента ST при ОКС
Используемые источники
- Guidelines for the diagnosis of heart failure. The Task Force on Heart Failure of the European Society of Cardiology. Eur Heart J 1995;16(6):741-51.
- Nieminen MS, Böhm M, Cowie MR, et al; ESC Committee for Practice Guideline (CPG). Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J 2005;26(4):384-416.
- ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J2012;33(14):1787-847.
- Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37(27):2129–200.
- Butler J, Braunwald E, Gheorghiade M. Recognizing worsening chronic heart failure as an entity and an end point in clinical trials. JAMA 2014;312(8):789–90.
- Dickstein K, Cohen-Solal A, Filippatos G, et al; ESC Committee for Practice Guidelines (CPG). ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail 2008;10(10):933-89.
- Nieminen MS, Brutsaert D, Dickstein K, et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J 2006;27(22):2725–36.
- Killip T 3rd, Kimball JT. Treatment of myocardial infarction in a coronary care unit. A two year experience with 250 patients. Am J Cardiol 1967;20(4):457–64.
- Khot UN, Jia G, Moliterno DJ, et al. Prognostic importance of physical examination for heart failure in non-ST-elevation acute coronary syndromes: the enduring value of Killip classification. JAMA 2003;290(16):2174–81.
- Mello BH, Oliveira GB, Ramos RF, et al. Validation of the Killip-Kimball classification and late mortality after acute myocardial infarction. Arq Bras Cardiol 2014;103(2):107–17.
- Forrester JS, Diamond GA, Swan HJ. Correlative classification of clinical and hemodynamic function after acute myocardial infarction. Am J Cardiol 1977; 39(2):137–45.
- Nicolau JC, Serrano CV Jr, Garzon SA, Ramires JA. Prognosis of acute myocardial infarction in the thrombolytic era: medical evaluation is still valuable. Eur J Heart Fail 2001;3(5):569–76.
- Siniorakis E, Arvanitakis S, Voyatzopoulos G, et al. Hemodynamic classification in acute myocardial infarction. Chest 2000;117(5):1286–90.
- Nohria A, Tsang SW, Fang JC, et al. Clinical assessment identifies hemodynamic profiles that predict outcomes in patients admitted with heart failure. J Am Coll Cardiol 2003;41(10):1797–804.
- Collins SP, Pang PS, Fonarow GC, et al. Is hospital admission for heart failure really necessary?: the role of the emergency department and observation unit in preventing hospitalization and rehospitalization. J Am Coll Cardiol 2013;61(2): 121–6.
- Heart Failure Executive Committee, Peacock WF, Fonarow GC, et al. Society of Chest Pain Centers Recommendations for the evaluation and management of the observation stay acute heart failure patient: a report from the Society of Chest Pain Centers Acute Heart Failure Committee. Crit Pathw Cardiol 2008;7(2): 83–6.
- Lee DS, Ezekowitz JA. Risk stratification in acute heart failure. Can J Cardiol 2014;30(3):312–9.
- Braunstein JB, Anderson GF, Gerstenblith G, et al. Noncardiac comorbidity increases preventable hospitalizations and mortality among Medicare beneficiaries with chronic heart failure. J Am Coll Cardiol 2003;42(7):1226–33.
- van Deursen VM, Damman K, van der Meer P, et al. Co-morbidities in heart failure. Heart Fail Rev 2014;19(2):163–72.
- Setoguchi S, Stevenson LW, Schneeweiss S. Repeated hospitalizations predict mortality in the community population with heart failure. Am Heart J 2007; 154(2):260–6.
Течение заболевания и стратификация риска при ОСН
Стратификация риска – одно из наиболее значимых в практическом отношении направлений научных исследований ОСН. В
то же время на стратификацию риска как на систему медицинской оценки возлагаются функции, с выполнением которых
с помощью традиционных классификаций справиться трудно: выбор типа медицинской помощи (например, решение вопроса
о том, следует больного госпитализировать или нет, а если да – то в отделение интенсивной терапии или отделение
общего типа), методов мониторинга за состоянием больных, средств лечения (из числа стандартных или резервных),
планирования продолжительности пребывания в клинике, тактики ведения больного на амбулаторном этапе.
Число пациентов, доставляемых в клиники по поводу СН, очень велико. В США, например, оно составляет около 1 млн
в год, однако примерно в половине этих случаев госпитализация не требуется . Поэтому полезно выделять
больных ОСН с наибольшим риском, явно нуждающихся в госпитализации (в отделения интенсивной терапии).
Сопоставление соответствующих критериев, предлагаемых группами наиболее авторитетных международных экспертов в
последние годы, показывает значительное сходство, а также тенденцию к упрощению и сокращению числа критериев с
течением времени (табл. 1) .
Литература
-
Management of acute coronary syndromes: acute coronary syndromes
without persistent ST segment elevation. Recommendations of the Task
Force of the European Society of Cardiology. Eur Heart J 2000; 21:
1406–32 -
Bertrand ME, Simoons ML, Fox KAA, et al. Management of acute
coronary syndromes in patients presenting without persistent ST-segment
elevation. The Task Force on the Management of Acute Coronary Syndromes
of the European Society of Cardiology. Eur Heart J 2002; 23: 1809–40. -
Braunwald E, Antman EM, Beasley JW, et al. ACC/AHA guideline update
for the management of patients with unstable angina and non–ST-segment
elevation myocardial infarction: a report of the American College of
Cardiology/American Heart Association Task Force on Practice
Guidelines (Committee on the Management of Patients With Unstable
Angina). 2002. Available at: http://www.
acc.org/clinical/guidelines/unstable/unstable.pdf -
ACC/AHA Guidelines for the Management of Patients with Unstable Angina
and Non–ST-Segment Elevation Myocardial Infarction. A Report of the
American College of Cardiology/American Heart Association Task Force on
Practice Guidelines (Committee on the Management of Patients with
Unstable Angina). JACC 200; 36: 970–1062 -
Hamm CW, Braunwald E. A classification of unstable angina revisited.
Circulation, 2000; 102 (1): 118-22 -
Myocardial Infarction Redefined—A Consensus Document of The Joint
European Society of Cardiology/American College of Cardiology
Committee for the Redefinition of Myocardial Infarction. JACC 2000;
36: 959-1062. -
Antithrombotic Trialists’ Collaboration. Collaborative meta analysis
of randomised trials of antiplatelet therapy for prevention of death,
myocardial infarction, and stroke in high risk patients. BMJ 2002; 324:
71–86. -
The Sixth (2000) ACCP Guidelines for Antithrombotic
Therapy for Prevention and Treatment of Thrombosis. Chest 2001; 119:
Suppl. -
Hirsh J, Anand S, Halperin JL, Fuster V. Guide to anticoagulant
therapy: Heparin. A statement for healthcare professionals from the
American Heart Association. Circulation 2001; 103: 2994-3018 -
De Backer G, Ambrosioni E, Borch-Johnsen K, et al. European
guidelines on cardiovascular disease prevention in clinical practice.
Third Joint Task Force of European and Other Societies on Cardiovascular
Disease Prevention in Clinical Practice. Eur Heart J. 2003; 17: 1601-10. -
Expert Panel on Detection, Evaluation, and Treatment of High Blood
Cholesterol in Adults. Executive summary of the Third Report of the
National Cholesterol Education Program (NCEP) Expert Panel on Detection,
Evaluation and Treatment of High Blood Cholesterol in Adults (Adult
Treatment Panel III). JAMA 2001;285:2486-97. -
Campeau L. Grading of angina pectoris. Circulation 1976; 54:522–3.
-
Hirsh J, Warkentin TE, Shaugnessy SG, et al. Heparin and low weight
heparin. Mechanism of action, pharmacokinetics, dosing, monitoring,
efficacy, and safety. Chest 2001; 119: 64S94 -
ACC/AHA guidelines for percutaneous coronary intervention (Revision
of the 1993 PTCA guidelines) – executive summary. A report of the
American College of Cardiology/American Heart Association task force
on practice guidelines (Committee to revise the 1993 guidelines for
percutaneous transluminal coronary angioplasty). Circulation 2001;
103: 3019-41 -
Kereiakes DJ, Montalescot G, Antman EM, et al. Lowmolecular-weidht
heparin therpy for non-ST-elevation acute coronary syndromes and during
percutaneous coronary intervention: an expert consensus. Am Heart J.
2002; 144(4): 615-24
Формулировка диагноза
Состоявшийся эпизод ОСН должен найти отражение в окончательном диагнозе. Документирование – важный пункт ведения
таких больных, поскольку ОСН является сильным предиктором прогноза их жизни. При появлении (возобновлении) ОСН
или ОДСН требуется внимательный анализ причин, выработка тактики наблюдения и лечения – сейчас и на отдаленную
перспективу. Информация об эпизоде ОСН важна для обеспечения преемственности в ведении больного. Между тем она
зачастую все же отсутствует или теряется в современном диагнозе, разрастающемся по мере расширения арсенала
возможностей.
Преобладающую часть случаев ОСН составляют эпизоды ОДСН у немолодых пациентов, для подавляющего большинства из
которых характерно наличие нескольких заболеваний сердца (гипертоническое сердце, ишемическая кардиомиопатия,
постинфарктный кардиосклероз, дегенеративные поражения клапанов, фибрилляция предсердий и т.д.) и
экстракардиальной коморбидности, также, как правило, множественной (хроническая болезнь почек, сахарный диабет,
анемия, хроническая обструктивная болезнь легких, цереброваскулярная болезнь, апноэ во время сна, болезни
щитовидной железы) и потенцирующей сердечную недостаточность и ее декомпенсацию . По существующей
традиции в начале диагноза указывают основное заболевание, а затем его следствия (их может быть немало, и они
также могут конкурировать с сердечной недостаточностью – почечная недостаточность, дыхательная недостаточность,
цереброваскулярная недостаточность). Так что затеряться диагнозу ОДСН в таких случаях есть где
С учетом
прогностической важности ОДСН и того, которое по счету это обострение, (рис. 4), сколь долго оно длилось, запись
об этом должна занимать заметное место в диагнозе (или сопроводительном эпикризе).
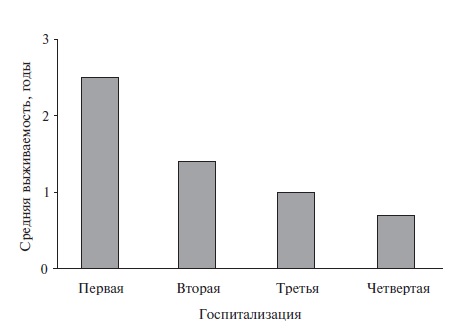 Рис. 4. Средняявыживаемость больных ОДСН
Рис. 4. Средняявыживаемость больных ОДСН
Что же касается вновь развившейся ОСН, то и в этом случае существует возможность не указать на это в выписном
эпикризе (диагнозе). Например, во многих случаях инфаркта миокарда явления умеренно выраженной ОСН удается
быстро купировать в отделении интенсивной терапии (после реваскуляризации), и к моменту выписки больного из
общего (кардиологического) отделения врачи о ней в диагнозе не упоминают как о несущественной детали анамнеза,
утратившей актуальность.
В заключение предлагаем примеры формулировок диагноза у больных ОСН:
Классификации ОСН при остром коронарном синдроме и инфаркте миокарда
Наиболее известны и изучены с точки зрения обоснованности применения (валидности) две системы оценки тяжести
ОСН, использующиеся в отделениях интенсивной терапии для коронарных больных – классификации Киллипа и
Форрестера.
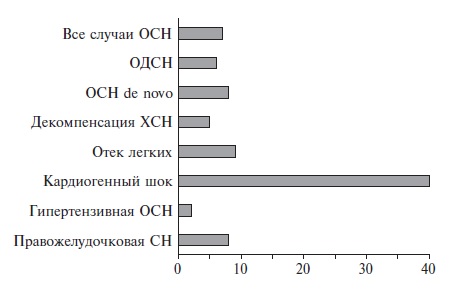 Рис. 1. Госпитальная смертность (%) при ОСН в зависимости от
Рис. 1. Госпитальная смертность (%) при ОСН в зависимости от
ее клинической формы (по данным регистра Euro Heart Failure Survey II )
Классификация ОСН, известная под именем Killip, была предложена и апробирована Томасом Киллипом и Джоном
Кимбалом для оценки тяжести и динамики поражения миокарда у больных инфарктом в 1967 году , когда еще
отсутствовали возможности эффективного лечения этого заболевания, т.е. восстановления проходимости пораженной
артерии. Основанная на учете клинических (и, возможно, рентгенологических) симптомов, она оказалось простой,
удобной и востребованной в клинической практике и традиционно используется во многих клиниках нашей страны.
Важным достоинством классификации является также доказанная валидность в условиях современного лечения. Наличие
ОСН и ее стадия (по Киллипу) являются сильным независимым предиктором смерти как в ближайшем, так и в отдаленном
периоде после инфаркта миокарда (как с подъемом, так и без подъема сегмента ST, при выполнении тромболизиса и
при катетерных вмешательствах) .
Классификация тяжести ОСН при ОКС (по Кил липу)
- Стадия I – отсутствие СН. Признаков сердечной декомпенсации нет.
-
Стадия II – имеется СН. Диагностические критерии: влажные хрипы над
нижними отделами легких, другие застойные изменения в легких, признаки легочной венозной гипертензии, ритм
галопа (за счет третьего тона). -
Стадия III – тяжелая СН. Явный отек легких с влажными хрипами над всей
поверхностью легких. -
Стадия IV – кардиогенный шок: артериальная гипотензия (систолическое
АД – 90 мм рт. ст. и ниже), периферическая вазоконстрикция (олигурия, цианоз, потливость).
Классификация Форрестера появилась на 10 лет позже и также была предназначена для стратификации ОСН у больных
инфарктом миокарда . Больные подразделяются на 4 группы (рис. 2) на основании, с одной стороны, клинических
признаков (гипоперфузия периферических тканей – нитевидный пульс, холодная липкая кожа, периферический цианоз,
артериальная гипотензия, тахикардия, спутанность сознания, олигурия, а также симптомы застоя в легких – хрипы,
изменения на рентгенограмме), а, с другой стороны, гемодинамических данных – снижение сердечного индекса (≤2,2
л/мин/м2) и повышение давления в легочных капиллярах (>18 мм рт. ст.).
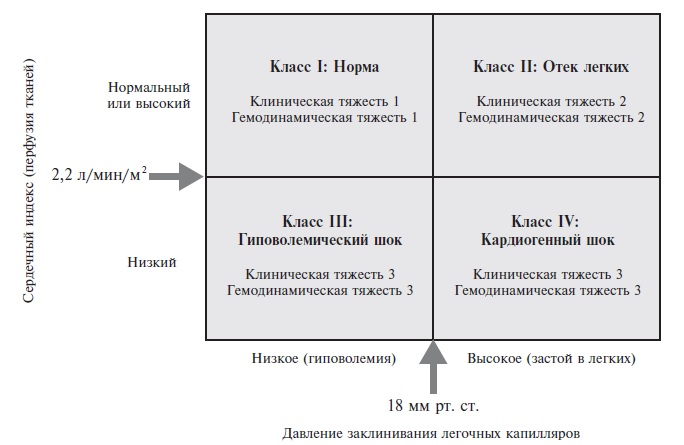 Рис. 2. Классификация тяжести острой сердечной
Рис. 2. Классификация тяжести острой сердечной
недостаточности при инфаркте миокарда (остром коронарном синдроме) Форрестера
Имеются немногочисленные исследования применимости данной классификации. Некоторые подтверждают ее валидность (а
именно, прогностическую значимость) в условиях современного (тромболитического) лечения инфаркта миокарда ,
а другие это отвергают, в частности, в связи отсутствием связи между показателями катетеризации правых камер
сердца (давление заклинивания) и прогнозом
Обращает на себя внимание усложненность данной классификации,
ее зависимость от инвазивных измерений, малочисленность публикаций об исследованиях, в которых она так или иначе
применялась, в том числе и крупных клинических испытаний. И если в оригинальной публикации предлагалось выбирать
лечение в зависимости от гемодинамического статуса, то сейчас, спустя почти 4 десятилетия, невозможно судить о
том, насколько эффективна такая стратегия
Наконец, следует отметить, что градации ОСН, установленные на
основании рассмотренных альтернативных классификаций, вполне совпадают лишь в 42% случаев, т.е. они скорее не
совпадают
Существует также классификация клинической тяжести сердечной недостаточности, основанная на оценке состояния
периферического кровообращения (перфузии периферических тканей) и данных аускультации легких (застойные явления)
– она относится скорее к ОДСН (рис. 3). Эта классификация предполагает выделение класса I («теплые и сухие»),
класса II («теплые и влажные»), класса III («холодные и сухие») и класса IV («холодные и влажные»).
Правомерность этой классификации была изначально валидировна (с точки зрения связи с прогнозом) при
кардиомиопатиях, и, хотя сведения о ее научной апробации крайне ограничены, по экспертному заключению может
применяться у больных ХСН (ОДСН) – госпитализированных или амбулаторных и .
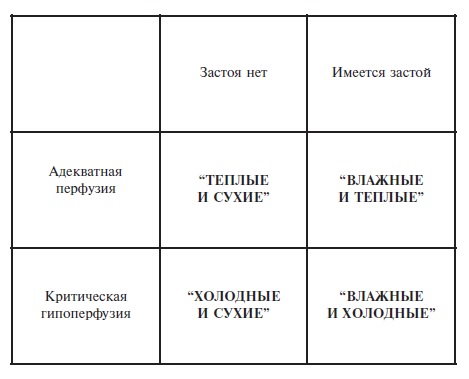 Рис. 3. Классификация клинической тяжести острой
Рис. 3. Классификация клинической тяжести острой
декомпенсации хронической сердечной недостаточности
Определение понятия «острая сердечная недостаточность»
В последние 2 десятилетия понятие ОСН претерпевало значительные изменения. В уточнении этого аспекта, как и в
изучении проблемы СН в целом, важную роль играет деятельность экспертов Европейского общества кардиологов
(European Society of Cardiology, ESC) и смежных научных обществ. Она выражается, в частности, в создании и
апробации согласованных официальных экспертных заключений – руководств для врачей. Всего четверть века назад в
первом из серии этих документов – в «Руководстве по диагностике сердечной недостаточности» экспертам
понадобилось уточнить, что «…термин ОСН часто используется исключительно для
обозначения острого кардиогенного отека легких, однако он может быть применен и к кардиогенному
шоку…», а далее рекомендовалось не использовать термин ОСН, а конкретизировать: либо отек легких,
либо кардиогенный шок.
Однако спустя всего одно десятилетие именно этот «нерекомендованный» термин и стал заглавным для нового издания
документа. «Руководство по диаг но стике и лечению ОСН» было подготовлено экспертами Европейского общества
кардиологов и Европейского общества интенсивной медицины . В нем и было сформулировано новое развернутое
определение ОСН:
ОСН – это быстрое возникновение жалоб и объективных расстройств, связанных с
нарушением функции сердца как на фоне предшествующего заболевания сердца, так и при его отсутствии.
Нарушения могут затрагивать систолическую и/или диастолическую функции миокарда, ритм сердца, пред- или
посленагрузку на него. Они часто означают угрозу для жизни, необходимость срочного лечения. ОСН может быть
самостоятельным, вновь возникшим (de novo) состоянием или острой декомпенсацией ХСН.
Это определение было принято за основу и фактически широко применяется на протяжении уже 15 лет, хотя в
последних двух версиях Руководства ESC по диагностике и лечению острой и хронической сердечной недостаточности
(2012 и 2016 гг.) оно выглядит более лаконичным и полностью клиническим определением (патофизиологические
аспекты оставлены в стороне), но по существу изменилось мало:
ОСН – термин, описывающий быстрое возникновение или нарастание жалоб и
объективных расстройств, свойственных сердечной недостаточности. Это опасное для жизни состояние, требующее
неотложного внимания и обычно приводящее к госпитализации.
Однако и новая версия определения не вполне безупречна. Во-первых, что касается быстрого появляющихся или
нарастающих симптомов, то весьма свойственные ОСН одышка и отеки не являются для нее строго специфичными.
Например, причиной внезапно возникшей одышки может быть не ОСН, а пневмония, пневмоторакс, иная патология
легких, почек, головного мозга. Увеличение отеков на ногах также не всегда вызвано ОСН, причинами могут быть
нефротический синдром, флеботромбоз и т.д. Поэтому определения СН должно основываться не на симптомах, свойственных ей, а на симптомах, вызванных ею. Установление этой взаимосвязи является важнейшей задачей
диагностики и дифференциальной диагностики.
Наряду с выяснением принадлежности симптомов к ОСН имеет значение оценка динамики, субъективной тяжести и
прогностической значимости симптомов. Для больных ХСН характерно волнообразное или неуклонное и довольно быстрое
(за часы или дни, но может быть и недели) нарастание одышки и отеков, которое означает декомпенсацию ХСН,
являющуюся наиболее частой разновидностью ОСН. ОСН соответствует такая выраженность субъективных симптомов,
которую можно охарактеризовать как нестерпимость для больного (например,
субъективное удушье). В остальном симптомы – субъективные (жалобы больного) или объективные (физические,
лабораторные, инструментальные параметры) – для установления их принадлежности к ОСН должны оцениваться с точки
зрения того, какую опасность они представляют, т.е. их прогностической значимости.
Фармакотерапия ОКС у пациентов с ХБП
Фибринолитическая терапия
Согласно рекомендациям Американского колледжа фундаментальной кардиологии и Американской ассоциации сердца, пациентам с ИМпST необходимо назначить фибринолитическую терапию в первые 12 ч после начала симптомов ишемии при отсутствии противопоказаний, в случае когда первичное чрескожное коронарное вмешательство (ЧКВ) не может быть выполнено в течение 120 мин.
С целью оценки влияния функционального состояния почек (креатинин плазмы, клиренс креатинина ) на отдаленные исходы у пациентов, получивших системную тромболитическаю терапию (ТЛТ), был проведен анализ результатов исследований TIMI-10A, TIMI-10B, TIMI-14 и InTIME-II. Данные корреляционного анализа свидетельствуют о наличии положительной взаимосвязи между стадией ренальной дисфункции и частотой внутричерепных кровоизлияний. В ходе анализа нескольких обзорных исследований также изучалась зависимость отдаленных исходов и эффективность ТЛТ от наличия ХБП у пациентов с ИМпST. В частности, в исследовании Hobbach et al. не было установлено четкой связи между исходной концентрацией креатинина плазмы и уровнем коронарного кровотока по шкале TIMI. В то же время наличие почечной дисфункции ассоциировалось с повышением смертности, однако не приводило к повышению частоты больших кровотечений. В другом исследовании, включавшем 5549 пациентов с ОКС без терминальной почечной дисфункции, наблюдавшихся на протяжении 5 лет после выписки, наличие умеренной либо тяжелой ХБП служило независимым предиктором смертности. При этом ТЛТ и ЧКВ являлись факторами, снижавшими летальность. По данным исследования GRACE, у пациентов с ИМпST либо БЛНПГ отмечалось повышение летальности и снижение эффективности реперфузионной терапии при условии снижения почечной функции. По сравнению со стратегией, не включавшей реперфузионные подходы, ТЛТ ассоциировалась с повышением смертности у больных с умеренной ХБП, в то время как при наличии тяжелой ХБП/нормальной функции почек летальность не повышалась. В ходе анализа результатов исследования ACSIS, включавшего пациентов с ОКС на фоне ХБП, было установлено отсутствие существенной разницы в уровне смертности в течение 7 дней после ЧКВ, ТЛТ либо при консервативной тактике ведения. Однако 30-дневное наблюдение показало, что в подгруппе ТЛТ смертность была существенно ниже по сравнению с подгруппами ЧКВ и консервативной стратегии.
Таким образом, оценка эффективности ТЛТ у больных с наличием ХБП является нерешенной задачей, несмотря на результаты вышеупомянутых исследований, указывающих на повышение частоты неблагоприятных исходов при снижении почечной функции
Установленное повышение частоты внутричерепных кровоизлияний после ТЛТ на фоне ХБП должно приниматься во внимание, в особенности с учетом того факта, что современные модели оценки риска интракраниальных кровотечений при ТЛТ не содержат в себе ХБП в качестве фактора риска. Помимо этого, ТЛТ также рекомендуется в качестве альтернативы ЧКВ при невозможности последнего, в т.ч
у пациентов с почечной дисфункцией.
Критерии оценки элевации сегмента ST при ОКС
- Степень подъема сегмента ST оценивается по расположению точки j (место перехода комплекса QRS в сегмент ST) относительно верхнего уровня интервала Р — R. При этом изменения должны регистрироваться как минимум в двух последовательных отведениях.
- Для мужчин старше 40 лет подъем сегмента ST на 2 мм и более в грудных отведениях V2–3 и на 1 мм и более в отведениях I, II, III, aVR, aVL, aVF, V1 и V4–6 считают патологическим.
- Для мужчин моложе 40 лет элевация сегмента ST, превышающая 2,5 мм в отведениях V2–3 и 1 мм и более в отведениях I, II, III, aVR, aVL, aVF, V1 и V4–6 считается патологической.
- У женщин элевация сегмента ST, превышающая 1,5 мм в отведениях V2–3 и 1 мм, в отведениях I, II, III, aVR, aVL, aVF, V1 и V4–6, считается патологической.
- При низком вольтаже менее выраженный подъем сегмента ST (0,5 мм и более) может считаться диагностически значимым.
- В дополнительных отведениях V7–9 диагностически значимым является подъем 0,5 мм.
- В дополнительных отведениях V3–4 подъем R на 0,5 мм считают патологическим.
- Элевация сегмента ST может быть транзиторной, в 20 % случаев происходит спонтанный тромболизис.
- Боковой инфаркт миокарда на фоне полной окклюзии левой огибающей артерии или диагональной ветви передней межжелудочковой коронарной артерии может привести к развитию проникающего ОИМ без признаков подъема ST или с очень незначительной элевацией ST только в отведении aVL. Потенциалы боковой стенки хуже всего отражаются при стандартной съемке ЭКГ.
Далее представлен порядок интерпретации ЭКГ при наличии депрессии сегмента ST.
- Степень депрессии оценивается в точке j и соотносится с нижним уровнем интервала Р — R.
- Депрессия является патологической только в том случае, если она зарегистрирована как минимум в двух последовательных отведениях.
- Депрессия сегмента ST не может быть признаком субэндокардиального инфаркта, если она является реципрокной.
- Депрессия сегмента ST, достигающая 0,5 мм и более, зарегистрированная в отведениях V2–3 и (или) составляющая 1 мм и более в отведениях I, II, III, aVR, aVL, aVF, V1 и V4–6, расценивается как признак острого субэндокардиального инфаркта (повреждения) миокарда.
- Появление депрессии глубиной 0,5 мм, не являясь признаком субэндокардиального инфаркта, свидетельствует о повышенном риске его развития. Если она персистирует, несмотря на применение всего арсенала соответствующей терапии, целесообразно проведение коронаропластики в течение 48 ч.
- Депрессия сегмента ST, превышающая 2 мм, зарегистрированная в трех и более отведениях, свидетельствует о неблагоприятном прогнозе. Риск смертельного исхода составляет 35% в течение ближайшего месяца и 47% в течение 4 лет, если не выполнена коронаропластика.
- Депрессия сегмента ST в восьми и более отведениях при сочетании с элевацией в отведениях aVR/ V1 является признаком поражения основного ствола левой коронарной артерии или поражения нескольких крупных коронарных артерий, если она достигает 1 мм.
Необходимо учитывать, что критерии ишемических изменений на ЭКГ не применяют для выявления инфаркта миокарда, если у пациента отмечаются нарушения внутрижелудочковой проводимости с выраженными изменениями реполяризации, синдром Вольффа — Паркинсона — Уайта, желудочковый замещающий ритм, а также искусственный водитель ритма, стимулирующий желудочки. В этих случаях имеются исходные нарушения реполяризации и изменения желудочкового комплекса.
Признаки гипертрофии желудочков, тромбоэмболии легочных артерий, а также электролитные нарушения затрудняют диагностику ОКС. В этих случаях следует в первую очередь учитывать клинические проявления заболевания.
Определение маркеров некроза миокарда (тропонина или MB-фракции КФК) и ЭхоКГ, выполненные в стационаре в процессе наблюдения, помогут верифицировать диагноз.
В ряде случаев подъем сегмента ST выявляется у пациентов без острого коронарного синдрома; так, у молодых мужчин элевация сегмента ST может достигать 3 мм в правых грудных отведениях. Кроме того, при синдроме ранней реполяризации регистрируется подъем сегмента ST, который имеет вогнутую форму и максимально выражен в отведении V4; примеры таких изменений представлены на рис. 3.
 Рис. 3. Варианты подъема сегмента ST в норме: а— характерен для лиц мужского пола, чаще регистрируется у молодых людей; б— синдром ранней реполяризации; в— неспецифические изменения реполяризации, проявляются вогнутым подъемом сегмента ST, инверсией зубца Т, характерная особенность — короткий интервал Q— T
Рис. 3. Варианты подъема сегмента ST в норме: а— характерен для лиц мужского пола, чаще регистрируется у молодых людей; б— синдром ранней реполяризации; в— неспецифические изменения реполяризации, проявляются вогнутым подъемом сегмента ST, инверсией зубца Т, характерная особенность — короткий интервал Q— T